Disciplina: Química 0 Curtidas
Os químicos do laboratório de análises de uma indústria de - FGV 2016
O texto seguinte refere-se à questão:
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio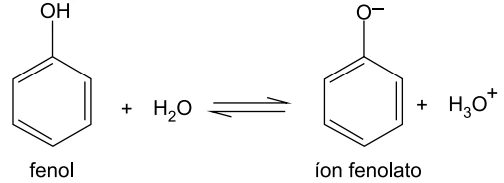
A concentração máxima permitida para fenóis em águas não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a concentração máxima permitida para fenóis pela resolução n.o 357 do CONAMA é de 0,003 mg/L.
Os químicos do laboratório de análises de uma indústria de tintas prepararam cinco amostras, cada uma com 1000 mL de efluente do processo, contendo fenol. A quatro delas, adicionaram – a cada uma separadamente – 0,1 mol das seguintes substâncias: KBr, NaCl, NaOH, HCl. A quinta amostra foi mantida apenas com o efluente. Após esse procedimento, fizeram análises da concentração de fenolato, C6H5O–, por instrumento de medida, em cada uma das cinco amostras.
Ao final dessa pesquisa, os químicos concluíram corretamente que a amostra que apresentou maior concentração de íon fenolato, dentre as cinco, foi aquela contendo
-
KBr, porque ela tem o pH mais alto.
-
NaCl, porque ela tem o pH mais baixo.
-
NaOH, porque ela tem o pH mais alto.
-
HCl, porque ela tem o pH mais baixo.
-
efluente sem reagentes, porque o pH era neutro.
Solução
Alternativa Correta: C) NaOH, porque ela tem o pH mais alto.
O equilíbrio químico que descreve o comportamento do fenol/íon fenolato é: A amostra que contém a maior concentração do íon fenolato é aquela em que o equilíbrio está mais deslocado para a direita. Para tanto, a adição de NaOH reduz a concentração (por reação de neutralização) do íon H3O+, deslocando o equilíbrio para o lado dos produtos, segundo o princípio de Le Chatelier.
A amostra que contém a maior concentração do íon fenolato é aquela em que o equilíbrio está mais deslocado para a direita. Para tanto, a adição de NaOH reduz a concentração (por reação de neutralização) do íon H3O+, deslocando o equilíbrio para o lado dos produtos, segundo o princípio de Le Chatelier.
Assim a amostra com maior concentração do íon fenolato é a de pH mais alto.
Resolução adaptada de: Curso Objetivo
Institução: FGV
Ano da Prova: 2016
Assuntos: Equilíbrio Químico
Vídeo Sugerido: YouTube