Disciplina: Química 0 Curtidas
Segundo a teoria das colisões efetivas, para que uma - FAMERP 2022
Segundo a teoria das colisões efetivas, para que uma reação ocorra é necessário que as moléculas dos reagentes colidam umas com as outras com orientação espacial adequada e energia mínima. Assim, qualquer alteração no meio reacional que interfira nesses dois fatores modifica a velocidade da reação. A figura mostra o sistema reacional gasoso 1 submetido a modificações que proporcionaram os sistemas 2 e 3.
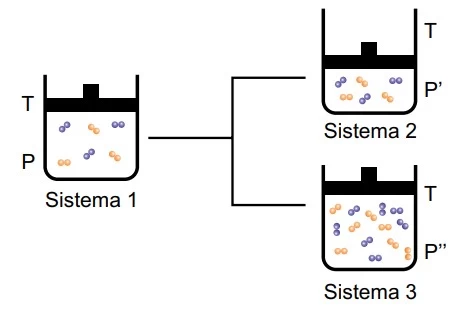
Considerando que as moléculas existentes nesses sistemas reajam entre si, as relações entre as velocidades (V) das reações dos sistemas 1 e 2 e dos sistemas 1 e 3 são, respectivamente,
-
V1 < V2 e V1 < V3
-
V1 = V2 e V1 > V3
-
V1 > V2 e V1 > V3
-
V1 < V2 e V1 > V3
-
V1 = V2 e V1 < V3
Solução
Alternativa Correta: A) V1 < V2 e V1 < V3
Sistema 1 para o sistema 2 – ocorre uma contração de volume aumentando o número de colisões efetivas, portanto, ocorre aumento da velocidade da reação.
Conclusão: V1 < V2
Sistema 1 (3 moléculas azuis e 3 moléculas laranjas) para o Sistema 3 (7 moléculas azuis e 7 moléculas laranjas) – ocorre um aumento da concentração de moléculas reagentes, portanto, ocorre aumento da velo cidade da reação devido ao aumento do número de colisões efetivas.
Conclusão: V1 < V3
Resolução adaptada de: Curso Objetivo
Institução: FAMERP
Ano da Prova: 2022
Assuntos: Cinética
Vídeo Sugerido: YouTube