Disciplina: Química 0 Curtidas
Um antiácido comercial em pastilhas possui, em sua - FUVEST 2019
Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve-se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatores sobre a velocidade de dissolução da pastilha, adicionou-se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo-se o tempo até a sua dissolução completa.
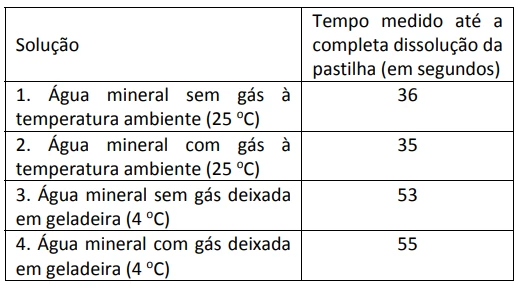
Para todos os experimentos, foi usada água mineral da mesma marca. Considere a água com gás como tendo gás carbônico dissolvido. Com base nessas informações, é correto afirmar que
-
o uso da água com gás, ao invés da sem gás, diminuiu a velocidade de dissolução da pastilha em cerca de 50%, uma vez que, como já possui gás carbônico, há o deslocamento do equilíbrio para a formação dos reagentes.
-
o uso da água com gás, ao invés da sem gás, aumentou a velocidade de dissolução da pastilha em cerca de 33%, uma vez que o gás carbônico acidifica a água, aumentando a velocidade de consumo do carbonato de sódio.
-
nem a mudança de temperatura nem a adição de gás carbônico na solução afetaram a velocidade da reação, uma vez que o sistema não se encontra em equilíbrio.
-
o aumento da temperatura da água, de 4 °C para 25 °C, levou a um aumento na velocidade da reação, uma vez que aumentou a frequência e a energia de colisão entre as moléculas envolvidas na reação.
-
o aumento da temperatura da água, de 4 °C para 25 °C, levou a um aumento na velocidade da reação, uma vez que facilita a liberação de gás carbônico da solução, deslocando o equilíbrio para a formação dos reagentes.
Solução
Alternativa Correta: D) o aumento da temperatura da água, de 4 °C para 25 °C, levou a um aumento na velocidade da reação, uma vez que aumentou a frequência e a energia de colisão entre as moléculas envolvidas na reação.
Pelos dados fornecidos, verifica-se que a presença ou não de gás carbônico na água praticamente não influi no tempo que demora para a efervescência total do comprimido. Entretanto, o aumento da temperatura implica diminuição relativamente grande do tempo para que a efervescência ocorra (aumento da velocidade da reação). Conclui-se que o aumento da temperatura de 4°C para 25°C levou a um aumento da frequência e da energia dos choques efetivos entre as partículas envolvidas, aumentando a velocidade da reação.
Créditos da Resolução: Curso Objetivo
Institução: FUVEST
Ano da Prova: 2019
Assuntos: Soluções Químicas
Vídeo Sugerido: YouTube