Disciplina: Química 0 Curtidas
Um professor de química fez uma demonstração em - UNESP 2021/Prova II
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2) pela reação, a quente, de ácido clorídrico (HCl) com 6,75 g de alumínio sólido (Al) sob forma de folhas amassadas.
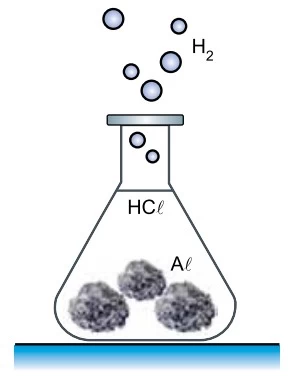
A equação que representa essa reação é:
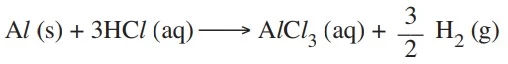
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m3.
Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de
-
6 × 104 N/m2.
-
8 × 104 N/m2.
-
5 × 104 N/m2.
-
9 × 104 N/m2.
-
4 × 104 N/m2.
Solução
Institução: UNESP
Ano da Prova: 2021
Assuntos: Cálculo
Vídeo Sugerido: YouTube

