Disciplina: Química 0 Curtidas
Na figura estão representadas as curvas pressão de vapor - VUNESP 2013
Na figura estão representadas as curvas pressão de vapor x temperatura para três solventes puros: benzeno (curva vermelha), água (curva azul) e ácido acético (curva verde).
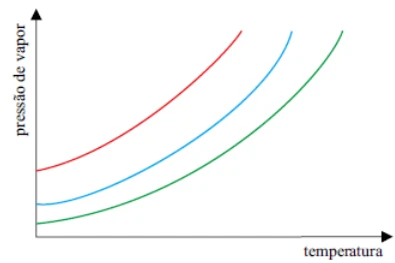
Sobre esses três solventes, é correto afirmar que
-
o ácido acético apresenta a menor temperatura de ebulição a 1 atm.
-
o benzeno apresenta a maior temperatura de ebulição a 1 atm.
-
a água apresenta a maior temperatura de ebulição a 1 atm.
-
na água ocorrem as interações intermoleculares mais intensas.
-
no ácido acético ocorrem as interações intermoleculares mais intensas.
Solução
Alternativa Correta: E) no ácido acético ocorrem as interações intermoleculares mais intensas.
Nessa questão, mesclam-se dois tópicos muito caros à Química: interações intermoleculares e propriedades coligativas. Primeiramente, as interações intermoleculares do ácido acético são mais expressivas em comparação às da água, pois a repulsão do elétrons por parte da cadeia carbônica aumenta a polaridade da molécula, detalhe orgânico que não aparece na molécula inorgânica da água. Soma-se a isso, ainda, o fato de no gráfico, para uma mesma pressão exercida, a temperatura de ebulição do ácido acético ser superior às demais devido à essa predominância intermolecular, sobretudo por se tratar de um solvente puro.
Resolução adaptada de: QConcursos
Institução: VUNESP
Ano da Prova: 2013
Assuntos: Propiedades Coligativas
Vídeo Sugerido: YouTube